
Longread
Snel en simpel genen repareren
Het blijkt een droom voor het moleculairbiologisch onderzoek. Met de techniek CRISPR-Cas9 zijn snel en goedkoop veranderingen in het DNA aan te brengen. ‘Het biedt hopelijk op zeer korte termijn de mogelijkheid om mensen beter maken. Dat is toch fantastisch.’
Met de gene-editingtechniek CRISPR-Cas kan heel nauwkeurig een geselecteerd gen worden doorgeknipt of vervangen door een ander gen.
Onder het prikbord op de kamer van hoogleraar John van der Oost zit een opgerold papiertje geklemd: bewijsmateriaal van een weddenschap. Krijgen de ontwikkelaars van gentechniek CRISPR-Cas9 een van de komende jaren de Nobelprijs – en daar twijfelt eigenlijk niemand aan – welke onderzoekers worden dan geëerd? Van der Oost en een postdoc zetten er een fles wijn tussen.
Nee, zegt Van der Oost, hij heeft niet op zichzelf gegokt. In NRC schreef kankeronderzoeker en voormalig columnist Piet Borst dat Van der Oost de Nobelprijs verdient voor zijn rol bij de ontwikkeling van CRISPR-Cas9. ‘Dat was leuk om te lezen, mooi dat iemand ons de credits gaf voor het basale werk dat we hebben verricht. Maar, Borst gaf het ook al aan, de prijs voor geneeskunde gaat niet naar een microbioloog.’ In vakbladen wordt Van der Oost wel degelijk als voorloper gezien van de drie onderzoekers die hoog op de favorietenlijstjes staan: de Française Emmanuelle Charpentier en de Amerikanen Jennifer Doudna (Berkeley) en Feng Zhang (MIT). De zegetocht van deze nieuwe techniek, waarmee nauwkeurig en goedkoop veranderingen in het DNA zijn aan te brengen, begint eind jaren negentig eigenlijk bij toeval in Wageningen.
‘We waren betrokken bij het ontrafelen van het genoom van een micro-organisme uit een geiser in Yellowstone’, vertelt Van der Oost. ‘Daarin vonden we stukjes repeterend DNA. In 2001 hebben we dat gepubliceerd, en vervolgens weer vergeten. We hadden geen idee waar het voor diende. In 2005 opperden Franse en Spaanse onderzoekers dat dit een afweersysteem is van bacteriën tegen virussen. Ik had net een NWO-Vici beurs gekregen, dat heeft het verschil gemaakt. Daardoor hadden we de mogelijkheid om er à la minute een postdoc en een aio op te zetten.’
Binnendringende virussen
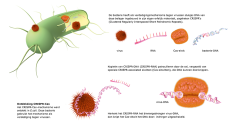
Dat leidde in 2008 tot een artikel in Science waarin de Wageningse groep uitlegt hoe het afweersysteem werkt van de bacterie E. coli tegen binnendringende virussen. De bacterie heeft daarvoor stukjes DNA van zijn belagers ingebouwd. Kopieën daarvan (CRISPR-RNA) patrouilleren door de cel. Herkent dit CRISPR-RNA een binnengedrongen virus, dan wringt het zich tussen de twee DNA-strengen van het virus en duwt die uit elkaar. Vervolgens brengen CRISPR-associated (Cas) eiwitten de doodsteek toe; ze knippen het DNA van het virus kapot. Indringer opgeruimd. De Wageningse studie liet ook zien dat het CRISPR-RNA zo is aan te passen dat het de eiwitschaar naar een gewenste plek in het DNA brengt. De publicatie leidde tot een stortvloed aan onderzoek naar varianten van dit afweersysteem. Het nu gevierde CRISPR-Cas9, ontdekt bij melkzuurbacteriën, is een eenvoudiger uitvoering dan het systeem dat Van der Oost in E. coli ontdekte. Het blijkt een schot in de roos voor een breed scala aan toepassingen in medische en biotechnologische laboratoria. Het knipmechanisme, de eiwitschaar die bacteriën gebruiken om zich te beschermen tegen virussen, werkt namelijk ook in planten-, dieren- en mensencellen. Daar kan het worden ingezet voor gene editing: het heel precies en snel herschrijven van het DNA. Daarvoor is wel een truc nodig: de eiwitschaar moet weten waar die moet knippen. Amerikaanse onderzoekers lukte het om ook hun schaar van steeds een andere gids te voorzien, die hem naar de gewenste plek in het erfelijk materiaal leidt.
Genbewerking wordt daarmee bijna een fluitje van een cent. Een onderzoeker bepaalt waar hij een verandering wil aanbrengen in het DNA van het organisme dat hij onderzoekt. Vervolgens bestelt hij online bij een leverancier een CRISPR-Cas9-set, met daarin een stukje RNA dat overeenkomt met de betreffende locatie in het DNA. Als de postbode de set heeft afgeleverd, is het voor een ervaren laborant een koud kunstje om die in de celkern te brengen. Daar gaat het RNA – de gids – met de schaar op zoek naar de plek in het erfelijk materiaal waar gesneden moet worden.
Gen inactiveren
Snijden klinkt destructief, maar soms is dat al genoeg om een fout gen te inactiveren. Vaak is het echter nodig om bij de CRISPR-Cas9- set ook het juiste gen aan te leveren. De cel gebruikt zo’n reparatieset om de oorspronkelijke fout recht te zetten. Afgelopen zomer publiceerde een team Amerikaanse, Chinese en Koreaanse onderzoekers hoe ze met deze techniek menselijke embryo’s konden ontdoen van de erfelijke hartafwijking hypertrofische cardiomyopathie. Er werd met grote precisie een minimale maar destructieve genetische afwijking vervangen door een gezond stukje DNA. Let wel: dit was een proef in het lab; gebruik van genetisch veranderde embryo’s is momenteel verboden. Waren die toch in de baarmoeder geplaatst, dan zouden er zeer waarschijnlijk gezonde kinderen zijn geboren.
Cellen programmeren
De onderzoeker kan nog een stap verder gaan door een reparatieset aan te bieden met een extra gen erin, om een nieuwe eigenschap toe te voegen. Op die manier behandelden Britse onderzoekers een baby die leed aan een ongeneeslijke vorm van leukemie. Met CRISPR-Cas9 programmeerden ze haar immuuncellen zodanig dat die de kankercellen te lijf gingen. De toepassingsmogelijkheden zijn echter veel breder dan alleen de gezondheidszorg. Precisie-instrument CRISPR-Cas9 is een droom voor allerlei vormen van moleculairbiologisch onderzoek. Oude technieken om het DNA te veranderen zijn lang niet zo nauwkeurig én veel bewerkelijker. Wat nu twee weken kost, duurde voorheen een paar maanden tot een halfjaar, en het resultaat was minder voorspelbaar.
Ondanks die precisie laat ook CRISPR-Cas9 een enkele keer een steekje vallen. Bijvoorbeeld door de knip op de verkeerde plek te zetten. ‘Als dat in een ander gen is, ben je misschien wel verder van huis’, aldus Van der Oost. ‘Willen we hiermee gentherapie bij mensen bedrijven, dan moeten we nog een paar stapjes zetten om het foutloos te krijgen. Daarin is de afgelopen jaren trouwens al grote vooruitgang geboekt.’
Bij de reparatie van de erfelijke hartziekte hypertrofische cardiomyopathie deed de schaar bijvoorbeeld in alle gevallen zijn werk op de juiste plek. Toch, zo schreven de wetenschappers, is er meer onderzoek nodig voordat deze vorm van genbewerking in de kliniek kan worden ingezet. Ook ethische overwegingen moeten besproken worden in een brede publieke discussie, constateerden zij. Hoe ver willen we gaan met het bewerken van menselijke genen? Dat is een extra prangende vraag omdat de techniek goedkoop is en eenvoudig valt toe te passen. Moeten we eerst grenzen stellen en dan pas volgende stappen zetten in het onderzoek? Van der Oost denkt dat dat valt te combineren. ‘Laten we vooral de discussie voeren hoe ver we willen gaan, maar in de praktijk zijn er ook al strenge waarborgen, zoals de regels voor het gebruik van embryo’s. Iedereen begint er steeds over of je van bruine ogen blauwe moet kunnen maken. Als er ooit mensen met veel geld dat soort idiote dingen willen, dan houden we dat toch niet tegen. Laten we vooral naar de positieve kant kijken. Denk je eens in dat we de mogelijkheid hebben om bij families een erfelijke ziekte uit de stamboom weg te halen! Wat tien jaar geleden begon met het ontrafelen van een verdedigingsmechanisme van bacteriën, biedt hopelijk op zeer korte termijn de mogelijkheid om mensen beter maken. Dat is toch fantastisch.’
Patenten
De opvolger van gentechniek CRISPR-Cas9 staat al in de startblokken. De Wageningse microbioloog John van der Oost beschreef en patenteerde vorig jaar samen met Feng Zhang van het Broad Institute van MIT een alternatief mechanisme om DNA te knippen: CRISPR-Cpf1, ook wel aangeduid als CRISPR-Cas12. ‘Het is spannend hoe succesvol dat wordt’, aldus Van der Oost. ‘De inkomsten daaruit beginnen binnen te druppelen. Er is afgesproken dat het geld dat Wageningen University ervoor ontvangt, zal worden ingezet worden voor het stimuleren van innovatief onderzoek in de biotechnologie.’
Feng Zhang is sinds 2013 in een zware juridische strijd verwikkeld over het belangrijkste patent op CRISPR-Cas9. Dat is toegekend aan Zhang, maar dat wordt aangevochten door Emmanuelle Charpentier en Jennifer Doudna. Tot nu toe houdt die beslissing stand in de rechtszaal. Deskundigen speculeren dat er honderden miljoenen dollars zijn gemoeid met dit patent.
Mutatie verifiëren
Ook bij andere leerstoelgroepen in Wageningen is CRISPR-Cas inmiddels een vertrouwde techniek. ‘Het is een belangrijk hulpmiddel in het onderzoek’, zegt Martien Groenen, hoogleraar Fokkerij en genetica. ‘Bijvoorbeeld om te bepalen waar een bepaald gen voor dient. Met gene-editing kun je dat uitschakelen en vervolgens kijken wat er gebeurt. We gebruiken de techniek momenteel om het effect van een mutatie in een gen bij de kip te verifiëren bij de zebravis. Die heeft datzelfde gen, maar het is een veel makkelijker proefdier.’
Op den duur kan CRISPR-Cas ook bijdragen aan de fokkerij, verwacht Groenen, al past daar een kanttekening bij. ‘In de fokkerij gaat het erom de balans te vinden tussen verschillende eigenschappen, zoals melkgift, groei of ziekteresistentie. Focussen op één verandering betekent vaak dat je inlevert op andere punten. Om een nieuwe eigenschap binnen een redelijke termijn in te bouwen zonder inteelt te veroorzaken, moet je duizenden dieren veranderen om geen andere eigenschappen te verliezen.’
Rijping van tomaat
Onderzoeker Ruud de Maagd van Wageningen Plant Research bestudeert welke genen belangrijk zijn voor de rijping en de houdbaarheid van tomaat en hoe die worden gereguleerd. Niet alleen schakelt hij genen uit met CRISPR-Cas, ook brengt hij soms twee keer een knip aan in dezelfde DNA-streng. Vaak lijmt de plantencel de beide uiteinden aan elkaar waardoor het stukje tussen de twee knips wegvalt. Dat levert informatie op over hoe de genen worden aangestuurd door het omliggende DNA. Uiteindelijk kan die kennis leiden, verwacht de onderzoeker, tot een tomaat die minder snel zacht wordt én goed smaakt, een beetje genetisch bijgestuurd met CRISPR-Cas. De grote vraag bij plantenveredelaars: valt zo’n tomaat onder de strikte regels voor toelating van genetisch gemodificeerde gewassen in de EU?
Voor eind 2016 had de EU beloofd een beslissing te nemen over CRISPR-Cas in de gmo-regelgeving, maar de Europese Commissie heeft het doorhakken van die knoop al twee keer uitgesteld. Frankrijk heeft de zaak inmiddels aanhangig gemaakt bij het Europese Hof. ‘Ik snap dat mensen bezorgd zijn over sleutelen aan DNA’, aldus De Maagd. ‘Maar de vraag is of CRISPR-Cas wel altijd onder de restricties van de gmo-regelgeving valt. Als je alleen een gen uitschakelt of wat DNA verwijdert, is zo’n verandering niet te onderscheiden van mutaties die ook in de natuur optreden.
Meer weten over CRISPRCas? Bekijk het dossier:

Auteur: Rik Nijland | Illustratie: Maartje Kunen
Dit is een verhaal uit Wageningen World. Wil je meer van dit soort verhalen lezen? www.wur.nl/wageningenworld
